Związki heterocykliczne
to związki pierścieniowe. W skład ich pierścieni wchodzą co
najmniej dwa różne pierwiastki. Jeśli interesuje Was chemia organiczna, na pewno o nich słyszeliście. Najczęstszymi
heteroatomami – czyli atomami pierwiastków, których obecność w
pierścieniu czyni go heterocyklicznym – są tlen, azot, siarka
albo fosfor. Heteroaromatyczność to obecność w układzie aromatycznym co
najmniej jednego heteroatomu.
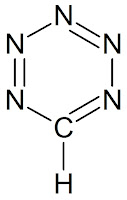 |
| W pentazynie za heteroatom możemy uznać atom węgla |
Warto nadmienić, że energia
aromatyzacji związków heteroaromatycznych jest mniejsza niż
analogicznych związków homocyklicznych, np. energia aromatyzacji
pirydyny jest nieco mniejsza niż energia aromatyzacji benzenu. Układ
aromatyczny nie musi powstać tylko w wyniku delokalizacji wiązań
podwójnych – delokalizowane mogą być też wolne pary elektronowe
heteroatomów. Np. pirol, homolog pirydyny, ma o wiele słabsze od
niej właściwości zasadowe. Dzieje się tak dlatego, że wolna
para elektronowa, która determinuje właściwości zasadowe amin,
współtworzy w pirolu pierścień
aromatyczny. W pirydynie natomiast azot tworzy proste wiązanie
podwójne z sąsiadującym atomem węgla, nie angażując przy tym
wolnej pary elektronowej. Związkiem izoelektronowym do pirolu jest
anion cyklopentadienowy. Podobną sytuację obserwujemy np. w
furanie.
 |
| od lewej: benzen, pirydyna, pirol, anion cyklopentadienylowy, furan |
 |
| kation piryliowy |
Ciekawą
grupę związków heteroaromatycznych stanowią pochodne kationu
piryliowego. Niestabilny na pierwszy rzut oka kation, w
którego skład wchodzi trójwiązalny atom tlenu o ładunku dodatnim
stabilizuje stosunkowo wysoka energia aromatyzacji pierścienia
aromatycznego. Jedna z par elektronowych tlenu jest wykorzystana do
wytworzenia wiązania podwójnego węgiel – tlen.
Ta molekuła
jest na tyle stabilna, że może nawet istnieć w zakwaszonym
roztworze wodnym.
 |
| cyjanidyna |
Tego typu związki występują także w naturze –
antocyjany nadają kolor np. kwiatom. Jak może pamiętacie, na
lekcjach chemii są czasem prezentowane właściwości soku z
czerwonej kapusty jako wskaźnika pH. Właściwości te wynikają z
obecności atomu tlenu w nienasyconym układzie cyklicznym barwnika –
cyjanidyny, która przy niższym pH odszczepia grupę hydroksylową,
tworzy jon oksoniowy i staje się układem aromatycznym.
 |
| borazyna |
Kolejnym
interesującym heterocyklem jest borazyna. Nazywana "nieorganicznym
benzenem" wykazuje dość dużą trwałość w stosunku do
innych cząsteczek, w których występują wiązania bor – wodór.
Azot tworzy wiązanie koordynacyjne z borem, co częściowo
aromatyzuje cząsteczkę, nadając jej w ten sposób większą
trwałość.







Komentarze
Prześlij komentarz